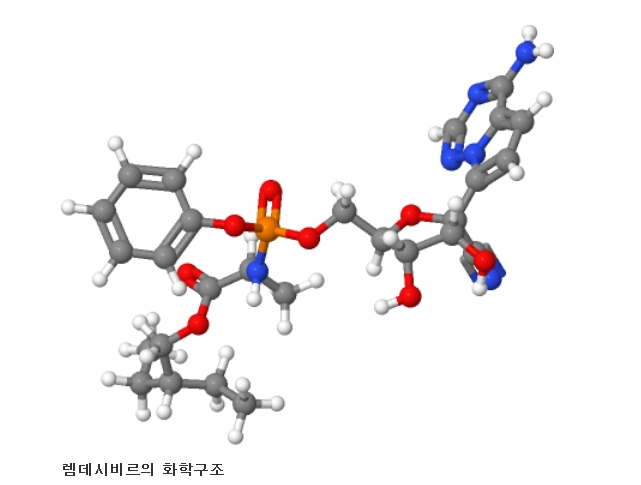
해외 외신들의 보도에 따르면, FDA는 이날 렘데시비르를 개발한 미국 제약회사 길리어드 사이언스에 서한을 보내 코로나19 치료제로서 렘데시비르를 긴급투여할 수 있도록 인가한다고 밝혔다.
긴급사용 승인은 연구와 임상실험이 진행중인 신약에 대해 내리는 임시 승인으로, 정식 사용허가를 받은 약품이 없을 때, 대체 약품으로 처방이 가능하도록 승인하는 것을 의미한다. 이에 따라 렘데시비르는 코로나바이러스감염증-19의 치료제로 승인받은 최초의 약품으로 기록되었다. 미국 정부의 지원으로 시행된 임상 실험에 의하면 렘데시비르는 코로나바이러스감염증-19 감염 환자의 회복 기간을 평균 약 31%(약 4일) 단축하는 것으로 보고되었다.
렘데시비르는 에볼라바이러스에 대한 치료제로 개발되었으나 이후 사스, 메르스 등 코로나바이러스 계열 질환에도 치료 효과가 있는 것으로 임상시험에서 밝혀지면서 2020년 코로나바이러스감염증-19의 치료제로 동정적 사용과 임상실험이 시행되었다.
개발 초기에는 에볼라바이러스의 치료제로 개발되었으나, 동물 임상시험 결과 사스와 메르스 등 코로나바이러스 계열의 바이러스성 질환에도 치료 효과가 있은 것으로 보고되었다.
올해 1월 미국에서 코로나바이러스감염증-19 환자에 대하여, 적절한 치료제가 없는 말기 환자에게 시판 전의 신약을 사용하여 치료의 가능성을 높이는 '동정적 사용 프로그램(Expanded Access Program)'에 따라 렘데시비르를 투여하여 상태가 호전되었다는 보고가 있으나 전적으로 이 약물의 효과 때문인지는 판단되지 않았다.
5월 1일 미국 식품의약국(FDA)은 임상시험 결과 코로나바이러스감염증-19 감염 환자의 회복 기간을 평균 약 31%(약 4일) 단축하는 것으로 보고되었다고 발표했다. 5월 25일 미국 국립보건원(NIH, National Institutes of Health)에서도 세계 10개국의 73개 의료기관이 참여한 국제 임상시험에서 입증된 치료 효과에 따라 렘데시비르를 코로나바이러스감염증-19의 표준치료제로 인정했다.
대학병원 한 전문의는 "FDA의 이번 조치는 렘데시비르가 코로나바이러스감염증-19의 치료에 안전성과 유효성이 있는 것으로 평가할 수 있다"며 "대체할 항바이러스제가 없는 상황에서 의학적으로 렘데시비르 도입이 필요하며 이에 대한 긴급사용승인이 필요하다고 본 것"이라고 말했다.
이건희 공유경제신문 기자 news@seconomy.kr
<저작권자 © 공유경제신문, 무단 전재 및 재배포 금지>